加载中...
加载中...
|
热门信息
第一节化学反应与能量的变化
教学目标:
知识与技能:
1、 了解化学反应中能量转化的原因和常见的能量转化形式;
2、 认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收是以发生变化的物质为基础的,能量的多少取决于反应物和生成物的质量;
3、 了解反应热和焓变的涵义;
4、 认识热化学方程式的意义并能正确书写热化学方程式。
过程与方法:
培养学生的自学能力、灵活运用知识分析问题的能力及热化学方程式的书写技能训练。
情感态度与价值观:
培养理论联系实际的科学态度和保护环境,节约能源的意识。
教学重点:
反应热的涵义,热化学方程式的书写方法和应用
教学难点:
△H的“+”与“—”,热化学方程式的书写。
课时安排:2课时
第一课时 反应热 第二课时 热化学方程式的书写方法和应用
教学方法:读、讲、议、练,启发式,多媒体辅助教学
教学过程: 第一课时 反应热
【复习引入】高一时曾做过铝片与盐酸、氢氧化钡与氯化铵晶体的反应实验。在这两个实验当中,能量有哪些变化?为什么?在我们学过的化学反应当中,还有哪些反应伴随着能量变化?请同学们讨论交流以下问题:
1、化学反应必定伴有能量变化,化学反应过程中当 时放出能量,当
时吸收能量。
2、从能量的角度看,断裂化学键要 ,形成化学键要 ,一个化学反应是释放能量还是吸收能量取决于 。
【讲解】通过以上讨论知道,在化学反应中,常伴有能量的变化,现在我们就来学习化学反应中的能量变化。
【板书】第一节 化学反应与能量变化
一、 反应热、焓变
【阅读】阅读教材相关内容,回答下列问题:
1、定义:在化学反应过程中 或 的热量,通常叫做反应热。
2、符合:用 表示。
3、单位:一般采用 。
4、可直接测量,测量的仪器叫量热计。
5、反应热产生的原因。(学生阅读后回答,教师板书)
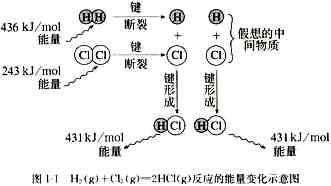
【思考】例如:H2(g)+Cl2(g) 2HCl(g)实验测的1mol H2与1mol Cl2反应生成2molHCl时放出184.6KJ的热量,从微观的角度如何解释?
2HCl(g)实验测的1mol H2与1mol Cl2反应生成2molHCl时放出184.6KJ的热量,从微观的角度如何解释?
【阅读】教材第2页图
【分析】(1)化学键断裂时需要吸收能量,吸收总能量为:436KJ+243KJ=679KJ
(2)化学键形成时需要释放能量,释放总能量为:431KJ+431KJ=862KJ
(3)反应热的计算:862KJ—679KJ=183KJ
【讲述】任何化学反应都有反应热,这是由于反应物中旧化学键断裂时,需要克服原子间的相互作用而吸收能量,当原子重新组成生成物新化学键形成时,又要释放能量,新化学键形成时所释放的总能量与反应物中旧化学键断裂时所吸收的能量的差就是此发应的反应热。
【思考】1、一个化学反应是放热还是吸热的决定因素是什么?
2、如何理解△H的“+”与“—”?
【学生活动】阅读教材第3页及图1—2思考、讨论、回答。
【学生回答】1、如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物放出能量,这就是放热反应;如果反应物所具有的总能量小于生成物所具有的总能量,反应物就需要吸收能量才能转化为生成物,这就是吸热反应。所以一个化学反应是放热还是吸热的决定因素是“反应物和生成物所具有的总能量的相对大小”。
2、对于放热反应,由于反应后放出热量而使反应本身的能量降低,所以规定放热反应的
△H为“—”;对于吸热反应,由于反应通过加热、光照等吸收了能量,而使反应本身的能力升高,所以规定吸热反应的△H为“+”。
所以上述反应H2(g)+Cl2(g) 2HCl(g),反应热测量的实验数据是184.6KJ/mol,与计算的数据183KJ/mol很接近,一般用实验数据表示,所以△H= —184.6KJ/mol。
2HCl(g),反应热测量的实验数据是184.6KJ/mol,与计算的数据183KJ/mol很接近,一般用实验数据表示,所以△H= —184.6KJ/mol。
【板书】6、反应热的表示方法:
放热反应:△H为“—”或△H<0
吸热反应:△H为“+”或△H>0
【投影】
例1、1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5KJ的热量,该反应的反应热为△H= KJ/mol。
例2、拆开1molH—H键、1molN—H键、1mol 分别需要的能量是436KJ、391KJ、946KJ,则1molN2生成NH3的反应热为 ;1molH2生成NH3的反应热为 。
分别需要的能量是436KJ、391KJ、946KJ,则1molN2生成NH3的反应热为 ;1molH2生成NH3的反应热为 。
【小结】若反应放热,说明反应物所具有的总能量>生成物所具有的总能量 △H<0
反应物的稳定性<生成物的稳定性
若反应吸热,说明反应物所具有的总能量<生成物所具有的总能量 △H>0
反应物的稳定性>生成物的稳定性
物质所具有的总能量越高物质越不稳定。
第二课时 热化学方程式的书写方法和应用
【复习引入】什么是化学反应热?如何表示?如何准确地描述物质间的化学反应及其能量变化?今天我们来学习热化学方程式及其应用。
【板书】二、热化学方程式
【学生活动】阅读教材相关内容,思考、讨论、回答下列问题:
1、 什么是热化学方程式,有何意义?书写步骤?
2、 书写热化学方程式为什么要注明物质的状态?
3、 化学计量数与△H的关系?
(让学生回答,并归纳小结)
【板书】1、定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
2、意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
3、书写步骤:
(1)写出化学方程式;
(2)标明各物质的聚集状态;
(3)注明反应的温度和压强(中学阶段可不特别注明);
(4)写出△H的值并标明“+”与“—”;
(5)检查化学计量数和△H值是否对应。
【讲解】书写热化学方程式要注明物质的聚集状态,因为物质呈现哪一种聚集状态(气、液、固)与他们所具有的能量有关。例如:水蒸气状态时所具有的能量与液态或固态时所具有的能量是不同的。
化学计量数与△H的关系:热化学方程式中,物质前的化学计量数不表示分子个数。因此它可以是整数,也可以是分数,对于相同物质的反应,当化学计量数不同时,其△H也不同。例如:
H2(g)+Cl2(g)=2HCl(g);△H= —184.6KJ/mol
1/2 H2(g)+1/2Cl2(g)=HCl(g);△H= —92.3KJ/mol
2 H2(g)+O2(g)=2H2O(g);△H= —483.6KJ/mol
H2(g)+1/2O2(g)=H2O(g);△H= —241.8KJ/mol
【学生根据以上热化学方程式,总结规律】
1、 △H与化学计量数成正比;
2、 无论化学计量数怎么变,△H的单位都规定为KJ/mol。
【课堂练习】书写热化学方程式:课后习题第3题(集体练习,典型板演)
【过度】我们研究热化学方程式,那么热化学方程式有什么含义?有何应用呢?
【讲解】例如:H2(g)+1/2O2(g)=H2O(g);△H= —241.8KJ/mol,表示1mol气态H2和1/2molO2反应生成1mol水蒸气,放出241.8KJ的热量。(在101Kpa,25℃时)
【板书】4、热化学方程式的含义:
描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。
5、热化学方程式的应用:
例1、已知C(s)+O2(g)=CO2(g);△H= —393.5KJ/mol
H2(g)+1/2O2(g)=H2O(g);△H= —241.5KJ/mol
欲得到相同热量,需充分燃烧C和H2的质量比约为 ( A )
A、12:3.25 B、3.25:12 C、1:1 D、6:1
例2、已知两个热化学方程式
2 H2(g)+O2(g)=2H2O(l);△H= —571.6KJ/mol
C3H8(g)+5O2(g)=3CO2+4H2O;△H= —2220KJ/mol
实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3847KJ,则混合气体中H2和C3H8的体积比是 ( )
A、1:3 B、3:1 C、1:4 D、1:1
教学设计说明:
尽可能利用每个教学环节让学生从阅读问题开始,通过自学、研究得出结论,使其学会学习,并学会教学研究的一般方法。