加载中...
加载中...
|
热门信息
高一化学期中复习练习
一、选择题
1.在实验室中,通常将金属钠保存在( )
A.水中 B.煤油中
C.四氯化碳中 D.汽油中
2.下列各金属作还原剂时,还原性最强的是( )
A.Al B.Fe C.Cu D.Na
3.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
4.下列关于Na和Na+的叙述中,错误的是( )
A.它们相差一个电子层 B.它们的化学性质相似
C.钠原子,钠离子均为同一元素
D.灼烧时,它们的焰色反应都呈黄色
5.除去Na2CO3 固体中少量NaHCO3的最佳方法是( )
A.加入适量盐酸 B.加入NaOH溶液
C.加热 D.配成溶液后通入CO2
6.镁、铝、铜三种金属粉末混合物,加入过量盐酸反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的有( )
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
7.下列有关金属元素特征的叙述正确的是( )
A.金属元素的单质只有还原性
B.金属元素的单质在常温下都为固体
C.含金属元素的离子都是阳离子
D.金属阳离子被还原不一定得到金属单质
8.将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
A.KSCN B.BaCl2 C.HCl D.NaOH
9.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中有( )
A.Cu、Fe3+ B.Fe2+、Fe3+
C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe
10.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.硫酸 B.硫酸铜 C.氯水 D.氯化铜
11.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入足量氨水:Al3++3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
12.下列离子在溶液中能大量共存的是( )
A.Al3+、NO3-、OH-、Cl- B.H+、Ba2+、Ag+、Cl-
C.Fe2+、Fe3+、Na+、NO3- D.Ca2+、H+、Cl-、CO32-
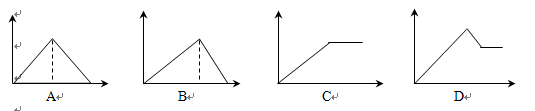
13.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
A.AlCl3溶液中加入过量氨水
B.Al2(SO4)3溶液中加入过量KOH溶液
C.MgCl2溶液中加入过量氨水
D.MgSO4溶液中加入过量KOH溶液
15.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了下列四种不同的方法,其中不可行的是( )
A.分别加入1 mol/L的盐酸溶液,看有无气泡产生
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察
火焰的颜色
二、填空题
16.明矾在水中的电离方程式是 ,明矾的用途 。
17.胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;(4)遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后有引起溃疡穿孔的危险。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;(2)凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液。
(1)请你推测,甲中含有的主要化学成分是 ;乙中含有的主要化学成分是 。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程
(3)试写出乙中含有的主要化学成分分别与稀盐酸和氢氧化钠溶液
的离子方程式
三、简答题
18.据媒体报道:社会上曾有不法分子,以黄铜(铜、锌合金)假冒黄金进行诈骗活动。请你设计实验,鉴别黄铜和黄金。
四、实验题
19.(1)鉴别KCl溶液和K2CO3的试剂是___________,
离子方程式为 。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是___________,
离子方程式为。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用___________方法,
化学方程式为 ____________________________。
(4)除去铁粉中混有铝粉的试剂是__________,离子方程式
五、计算题
20.现有镁铝铜合金1.2 g,加入过量的盐酸中,在标准状况下放出氢气1.12 L,反应后过滤得沉淀0.2 g。若将此合金放入过量的烧碱溶液中,反应后,在标准状况下,大约能产生多少升氢气?
一、选择题
1.B2.D3.D4.B5.C6.A7.D8.D9.D10.C11.D12.C13.D
14.B 15.A
二、填空题
16.KAl(SO4)2=K++Al3++2SO42- 净水剂
17.(1)NaHCO3;Al(OH)3; (2)HCO32-+H+=CO2↑+H2O;
(3)Al(OH)3+3H+=Al3++3 H2O Al(OH)3+OH-=AlO2-+2H2O
三、简答题
18.分别取样放入稀硝酸(或盐酸)中,能溶解的是黄铜,无反应
是黄金。
19.(1)盐酸 CO32-+2H+=CO2↑+H2O;
(2)盐酸 HCO3-+H+=CO2↑+H2O;
(3)加热 2NaHCO3=Na2CO3+CO2↑+H2O
(4)氢氧化钠溶液 2Al+2NaOH+2H2O=2NaAlO2+3H2
五、计算题
20.解:m(Cu)=0.2 g
Mg ~ H2 2Al ~ 3 H2
1 mol 1 mol 2 mol 3 mol
n1 n1 n2 3/2 n2
24 ×n1+27 ×n2=1.2 g-0.2 g=1.0 g
n1+n2=1.12 L÷22.4 L / mol=0.05 mol
n1=0.017 mol n2=0.022 mol
2 mol 67.2 L
0.022 mol V
V=0.74 L