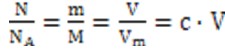加载中...
加载中...
|
热门信息
1. 常见的有机物有:
甲烷、乙烯、苯、乙醇、乙酸、乙酸乙酯、糖类、油脂、蛋白质等。
2. 常见的混合物有:
煤、石油、漂白粉;硬铝、黄铜、钢等合金;氯水,氨水等溶液,胶体。
3. 液氯、液氨、冰醋酸属于纯净物。
4. 常见的电解质有:酸、碱、盐等,其在水溶液中能发生电离。
5. 鉴别溶液和胶体的方法:丁达尔效应
6. 区别胶体与其它分散系的根本依据:分散质粒子直径 10-9~10-
7. 反应前后元素化合价发生变化的反应是氧化还原反应。一般而言,反应物或生成物中有单质的一定是氧化还原反应。
8. 失高氧 还原剂:失去电子,化合价升高,被氧化(发生氧化反应、生成氧化产物),是还原剂(有还原性)
9. 摩尔是物质的量的单位
10. 摩尔质量的单位g/mol或g.mol-1
11. 22.4mol/L的使用条件:
①标准状况下(
13. c(浓溶液)·V(浓溶液) = c(稀溶液)·V(稀溶液)
14. c=1000ρω/M
15. 配制一定物质的量浓度溶液必需的仪器:
×× mL容量瓶、烧杯、玻璃棒、胶头滴管。
16. 过滤用于分离固体和液体的混合物,主要仪器:漏斗。
17. 蒸馏用于分离液体混合物,如:乙醇和水的混合物。冷凝水“下进上出”。
18. 萃取可用于提取碘水中的碘单质。主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不可使用酒精。
19. 分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水。主要仪器:分液漏斗。使用时注意“上倒下放”。
20. 蒸发的主要仪器:蒸发皿。当蒸发皿中出现较多的固体时,停止加热。不可加热至蒸干。
21. 原子结构模型:道尔顿——实心球模型;汤姆生——葡萄干面包式;卢瑟福——带核的原子模型;玻尔——电子云模型。
22. 符号 ,其中:质量数= A、 质子数= Z、 中子数= A-Z、 电子数= Z
,其中:质量数= A、 质子数= Z、 中子数= A-Z、 电子数= Z
原子序数=核电核数=质子数=原子的核外电子数
质量数(A)=质子数(Z)+中子数(N)
如: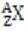 其中:质量数=14,质子数=6,中子数=14-6=8,电子数=6
其中:质量数=14,质子数=6,中子数=14-6=8,电子数=6
23. 同位素:质子数相同,中子数不同的原子互为同位素。如1 1H、2 1H、3 1H
24. 氢氟酸应存放在塑料瓶中,不能存放在玻璃瓶中。
25. 氢氧化钠溶液在存放时不能使用玻璃塞。
26. 金属钠存放在煤油中。 氯水存放在棕色瓶中。
27. 托盘天平精确到
28. 可直接加热的仪器:试管﹑蒸发皿、坩埚。
29. 点燃可燃气体前要验纯。
30. 酒精着火应迅速用湿抹布盖灭,钠、钾着火用细沙盖灭。
31. 离子检验
|
离子 |
所加试剂 |
现象 |
离子方程式 |
|
Cl- |
稀HNO3和AgNO3 |
产生白色沉淀 |
Ag++Cl-=AgCl↓ |
|
SO42- |
稀HCl和BaCl2 |
加稀盐酸无明显现象,滴入BaCl2溶液有白色沉淀 |
SO42-+Ba2+=BaSO4↓ |
|
Fe3+ |
KSCN溶液 |
溶液呈血红色 |
|
|
Fe2+ |
先加KSCN溶液,
再加氯水 |
先无明显变化,
后溶液呈红色 |
2Fe2++Cl2=2Fe3++2Cl- |
|
NH4+ |
NaOH溶液,加热,
湿润红色石蕊试纸 |
试纸变蓝 |
|
|
Na+ |
焰色反应 |
火焰呈黄色 |
|
|
K+ |
焰色反应 |
透过蓝色钴玻璃,火焰呈紫色 |
|
|
Al3+ |
NaOH溶液至过量 |
先产生白色沉淀,
后沉淀逐渐溶解 |
Al3++3OH-=Al(OH)3↓
Al(OH)3+ OH-= AlO2-+2H2O |